5. Stabilität organischer Moleküle¶
5.1. Weshalb organische Moleküle beständig sind¶
Damit es organische Moleküle geben kann, dürfen sie nicht zu schnell zerfallen. Es müssen also zwei Bedingungen erfüllt sein:
Sie dürfen nicht von selber auseinanderfallen, also mit sich selber zu kleineren Molekülen reagieren. Mit Bindungsenergien kann man sehr schön zeigen, dass Ketten aus C-Atomen nicht zerfallen, während Ketten aus N- oder O-Atomen sehr gut zerfallen. Im ersten Abschnitt geht es um diese Frage.
Sie dürfen nicht mit anderen allgegenwärtigen Molekülen wegreagieren, beispiels-weise mit Wasser oder Sauerstoff. Wie wir wissen, brennen die meisten organischen Stoffe gut, sie reagieren also mit Sauerstoff. Aber die Reaktion startet wegen der hohen Aktivierungsenergie nicht von selbst (man muss Holz anzünden, damit es brennt). Wenn Sauerstoff vorhanden ist, sind organische Moleküle zwar nicht wirklich stabil (sie brennen ja), aber immerhin metastabil: unter normalen Bedingungen überdauern sie dennoch lange. Die Gründe für dieses metastabile Verhalten werden wir im zweiten Teil betrachten.
5.2. Organische Moleküle sind stabil gegen Zerfall¶
Eine Kette aus C-Atomen und H-Atomen, in der sich Doppel- und Einfachbindungen abwechseln, kann in Prinzip zu C2H2 zerfallen, genauso wie eine analoge Kette aus N-Atomen in einzelne N2-Moleküle zerfallen kann. Dies ist möglich, weil es von den Atomen her genau aufgeht und nirgendwo die Edelgasregel verletzt wird.
Berechne die Reaktionsenthalpie für diese Reaktion pro mol Einheiten (also pro mol C2H2 bzw. pro mol N2). Tipp: zerschneide die Kette gedanklich in genau gleich-artige Elemente. Jedes dieser Elemente enthält gleich viele Atome und Elektronenpaare, wie die kleinen Moleküle darunter. Berechne nun Energie, die zum Spalten aller Bindungen in diesen Element nötig ist und vergleiche sie mit der Energie, die beim Zusammensetzen der kleinen Moleküle frei wird.
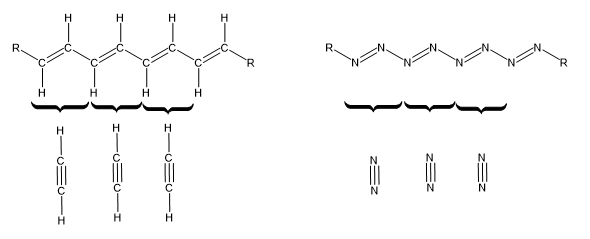
Abb 1: Ketten aus C- und N-Atomen könnten im Prinzip in Moleküle mit Mehrfachbindungen zerfallen.¶
| Reaktionsenergie | |
|---|---|
| Reaktionsenergie des Zerfalls der C-Kette | kJ/mol |
| Reaktionsenergie des Zerfalls der N-Kette | kJ/mol |
Was lässt sich aus dem Resultat über die Stabilität von Ketten aus C- oder N-Atomen aussagen?
Folgende Abbildung zeigt die Bindungsenergien von Einfach-, Doppel- und Dreifachbindungen zwischen C-, N- und O-Atomen. Statt zu rechnen, könnte man auch direkt mit dieser Grafik begründen, wie C-Ketten gegen Zerfall stabil sind, nicht aber Ketten aus N- und O-Atomen. Wie müsste man dabei argumentieren?
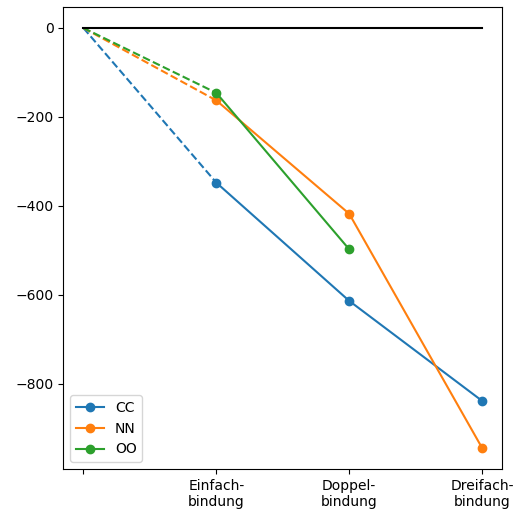
Abb 2: Bindungsenergien von Einfach-, Doppel und Dreifachbindungen.¶
5.3. Organische Moleküle in der Reaktion mit Sauerstoff zugleich instabil und reaktionsträge¶
Organische Moleküle enthalten viele C-H und C-C -Bindungen. Diese sind natürlich schwach polar oder gänzlich unpolar und die Atome sind elektropositiv. Wenn sie mit Sauerstoff reagieren, ergeben sich hingegen stark polare Bindungen, da Sauerstoffatome stark elektronegativ sind. Daher ist die Verbrennung organischer Stoffe energetisch sehr günstig und es wird dabei viel Wärme frei. Aus diesem Grund sind beispielsweise Fette so geeignete Energiespeicherstoffe.
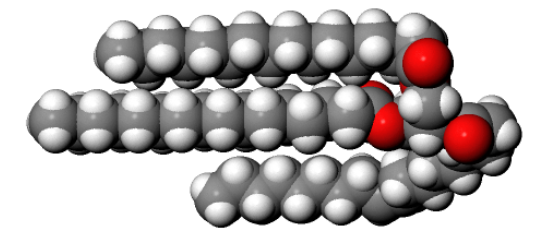
Abb 3: Fettmoleküle enthalten recht lange C-Ketten. In anderen Stoffklassen wie Kohlehydraten, Eiweissen oder DNS sind die Ketten noch viel länger.¶
Obwohl in solchen Reaktionen viel Energie frei wird, sind organische Moleküle dank der bemerkenswert grossen Aktivierungsenergie erstaunlich inert (sie regieren nicht weg). Während sich z.B. weisser Phosphor (P4) an Luft spontan entzündet, können manche organische Moleküle Jahrmilliarden überdauern. Dies hat vor allem folgende Gründe:
C-Atome sind relativ klein (weit oben im PSE) und die Rümpfe sind relativ schwach geladen und stossen sich relativ wenig ab. Daher ist die C-C-Bindung kurz (154 pm), so dass der Abstand zwischen den Bindungselektronen und den Rümpfen klein ist, was zu vergleichsweise starken Anziehungskräften und einer starken Bindung führt.
C-Atome haben weder eine besonders grosse noch eine besonders kleine Rumpfladung (4+). Sie haben daher eine mittlere Elektronegativität und können keine extrem polaren Bindungen eingehen, die energetisch besonders günstig wären. Es lässt sich daher gar nicht übermässig viel Energie freisetzen.
Da jedes C-Atom in vier Raumrichtungen Bindungen eingeht, sind die Bindungen in den Ketten räumlich gut abgeschirmt. Daher haben Reaktionen, in deren Verlauf eine C-C-Bindung gespalten wird, meist hohe Aktivierungsenergien.
Und schliesslich ist auch das Sauerstoffmolekül selbst erstaunlich reaktionsträge. Wenn die Atmosphäre Fluorgas enthielte, so würde augenblicklich alles in Flammen aufgehen. Nicht so bei Sauerstoff. Dies hat mit einer sehr aussergewöhnlichen Eigenschaft der Hülle von Sauerstoff zu tun, die zu einer hohen Aktivierungsenergie für die Reaktion mit normalen Stoffen führt. Die Besonderheit von Sauerstoff besteht darin, dass ein Elektronenpaar nicht wirklich gepaart ist, so dass Sauerstoff ein so genanntes Diradikal ist - aber das ist ein anderes Thema.
Die ersten beiden Gründe bewirken, dass die Reaktionsenergien einer Reaktion nicht allzu gross sind, die letzten beiden, dass die Aktivierungsenergien hingegen sehr gross sind. Aus diesen Gründen sind C-C-Bindungen gegenüber der Reaktion mit Sauerstoff zwar nicht stabil, aber immerhin metastabil: sie können Jahrhunderte oder Jahrtausende überdauern.
Weiter zur nächsten Seite
Zurück zum Start
Zurück zum Molekularium