1. Bindungsenergie¶
Folgende Abbildung zeigt ein Wasserstoffmolekül: Zwei H-Atom-Kerne, die aus einem Proton bestehen, werden durch ein Elektronenpaar zusammengehalten.
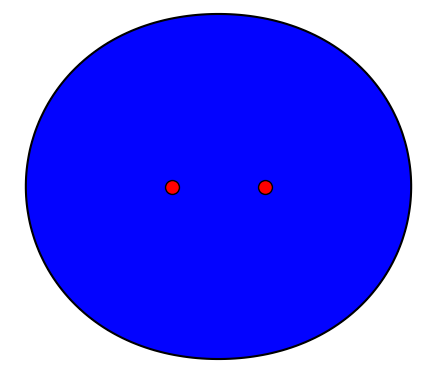
Abb 1: Wasserstoffmolekül¶
Diese Bindung ist jedoch nicht völlig starr. Durch Stösse oder die Absorption von Strahlung können Bindungen in Schwingung geraten.
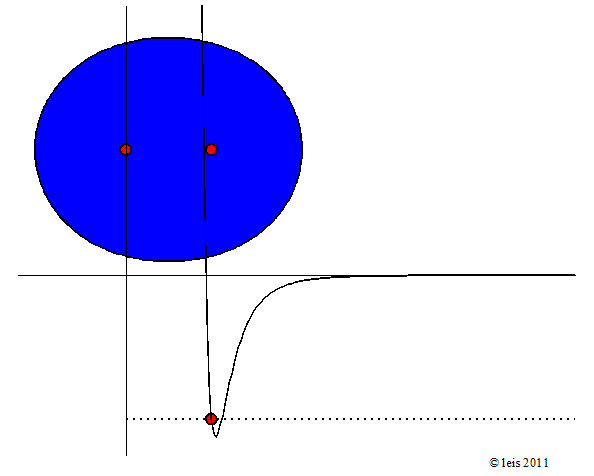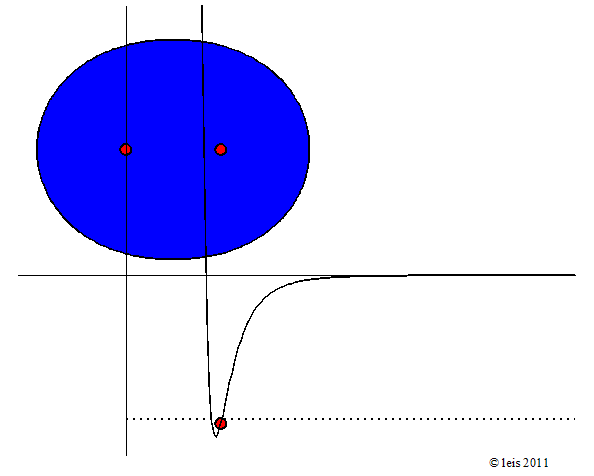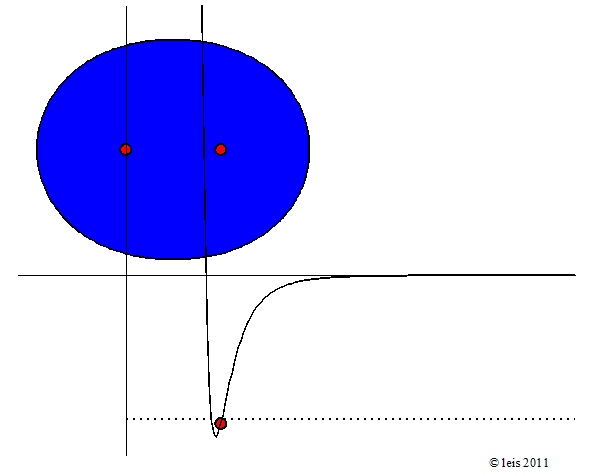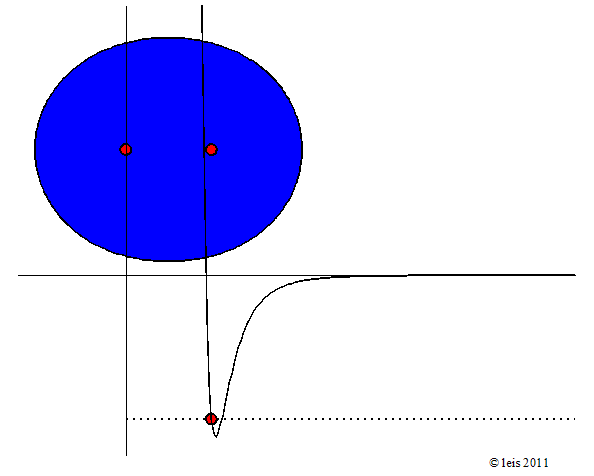
Abb 2: Schwingende Bindung zwischen H-Atomen.¶
Wird mehr Energie zugeführt, so wird die Schwingung heftiger:
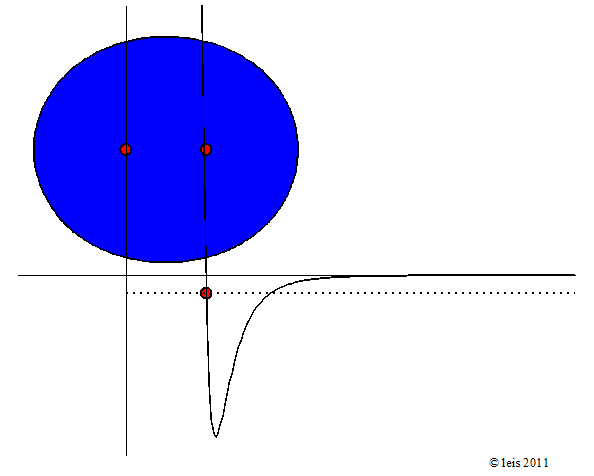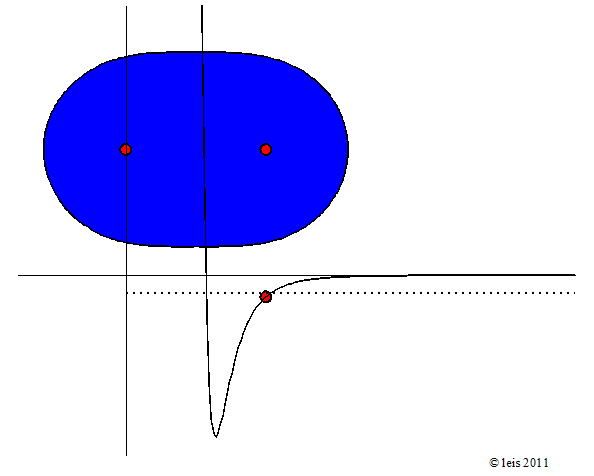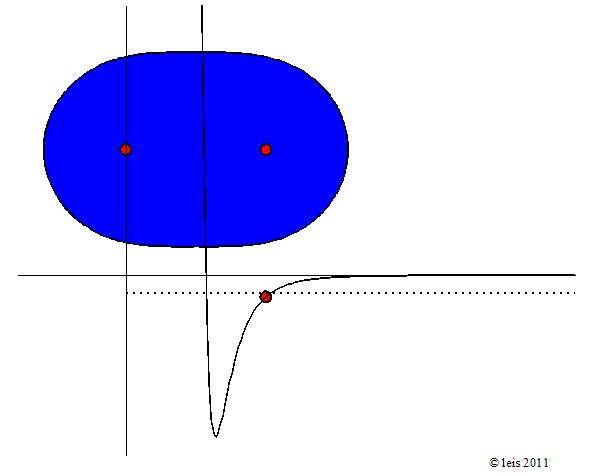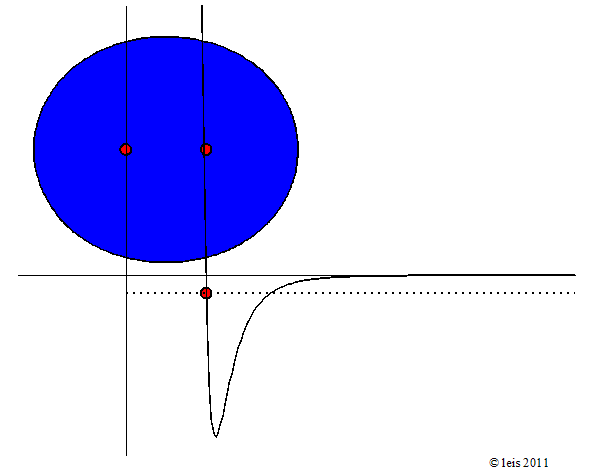
Abb 3: Stärker angeregte Wasserstoffbindung.¶
Dabei zeigt die Kurve unter dem Molekül die potentielle Energie (y-Achse) der Bindung als Funktion des Abstandes der beiden Kerne (x-Achse).
Aber wieso kommt es zu dieser Schwingung? Weshalb fällt das Molekül nicht einfach auseinander?
Wenn sich die Kerne auseinanderbewegen, so sammelt sich zwischen den Kernen insgesamt
an. Denn zwischen den Kernen werden die Elektronen von beiden Kernen angezogen, was energetisch günstig ist. Und da der Raum dort nun grösser ist, kommen sich die Elektronen gegenseitig weniger in die Quere, so dass die Elektronenladungswolken vermehrt zwischen die Kerne rücken. Daher werden die Kerne nun stärker
gezogen und bewegen sich wieder aufeinander zu.
Wenn sich die Kerne hingegen ganz nahe kommen, gibt es nur noch relativ wenig Elektronenladung dazwischen. Daher stossen sie
stärker ab und bewegen sich wieder auseinander.
Wenn die Kerne genau den richtigen Abstand haben, den Abstand von Abbildung 1, so ist die Anziehung eines Kerns durch die Elektronen in der Mitte genau gleich gross wie die Abstossung durch den anderen Kern, so dass sich die beiden Kräfte
. Da aber insgesamt keine Kraft auf die Kerne wirkt, bewegen sich diese nicht.
Bei einer solchen Schwingung wird ununterbrochen Bewegungsenergie (\(E_{kin}\)) in potentielle Energie (\(E_{pot}\)) umgewandelt und umgekehrt: Wenn die Bindung maximal gestaucht (Abbildung 4 Punkt A) oder gestreckt (Punkt B) ist, stehen die Kerne still und die Bewegungsenergie ist \(0\), während die potentielle Energie maximal ist. Im Gleichgewichtsabstand (C) erreicht \(E_{pot}\) den tiefsten Punkt. Dann ist \(E_{pot}\) minimal und \(E_{kin}\) maximal.
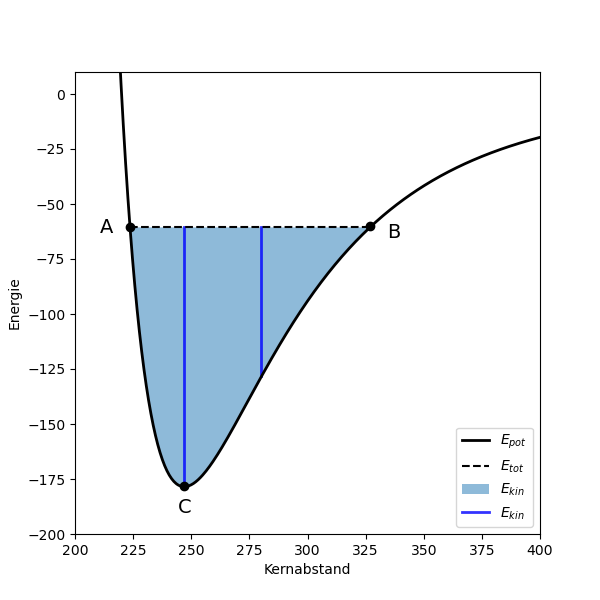
Abb 4: Energie schwingender Bindungen (Lennard-Jones-Potential). Die gestrichelte Linie zeigt die totale Energie einer bestimmten Schwingung zwischen den Auslenkungen A und B. Die ausgezogene Kurve stellt die potentielle Energie dar und der blaue Bereich bzw. die blauen vertikalen Linien die Bewegungsenergie.¶
Wenn man genug Energie zufügt, kann die Bindung auch gespalten werden:
Um die Kerne in Schwingung zu versetzen, muss Energie hinzugefügt werden. Um die Kerne ganz voneinander zu entfernen und die Bindung zu trennen, muss man mindestens den Betrag der so genannten Bindungsenergie hinzufügen.
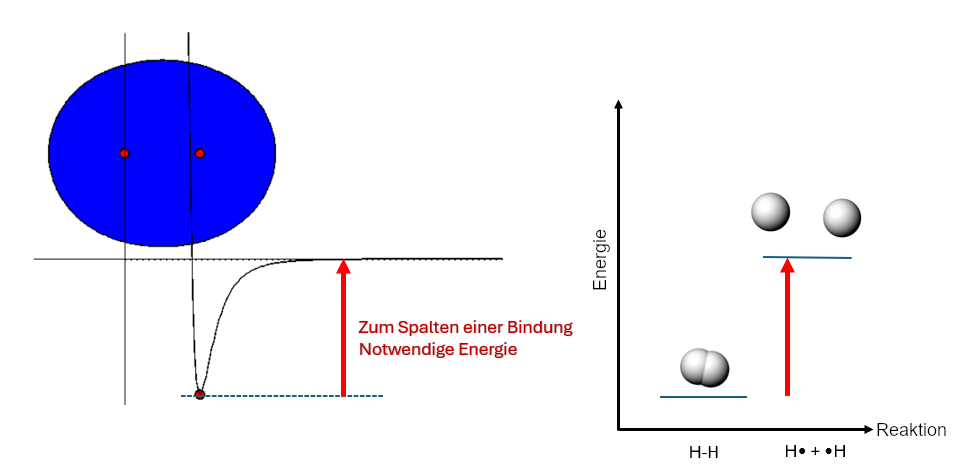
Abb 5: Zum Spalten einer Bindung notwendige Energie¶
Genau genommen ist die Bindungsenergie allerdings umgekehrt definiert: Sie ist definiert als die Energie, die frei wird, wenn zwei Atome eine Bindung ausbilden. Der Betrag ist allerdings genau derselbe, einzig der Pfeil weist nach unten statt nach oben und die Energie ist negativ. Daher sind Bindungsenergien stets negativ.
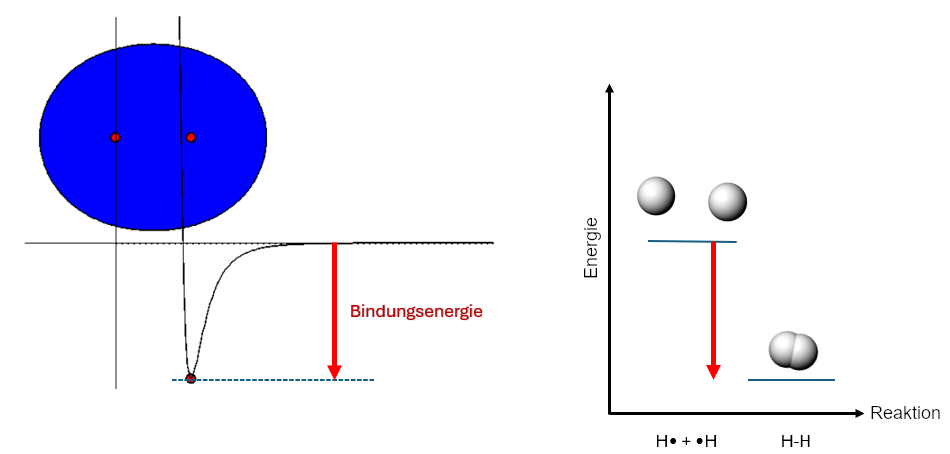
Abb 6: Bindungsenergie¶
Angegeben wird die Bindungsenergie normalerweise in \(\frac{kJ}{mol}\): Die Bindungsenergie ist also die Energie, die frei wird, wenn ein mol Bindungen geknüpft werden.
Ein häufiger Irrtum besteht darin , dass Bindungsenergie in der Bindung gespei-chert sei und beim Bruch der Bindung freigesetzt werde. Tatsächlich ist es umgekehrt: Eine Bindung zu lösen erfordert Energie. Die Bindungsenergie entspricht der freigesetzten Energie bei der Bindungsbildung und geht an die Umgebung “verloren”, wenn aus Atomen Moleküle werden.
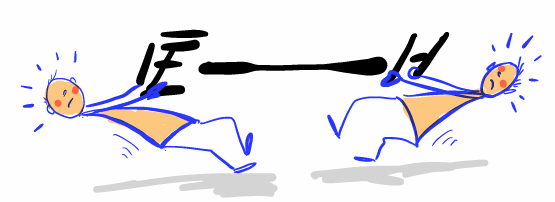
Abb 7: Das Zerreissen von Bindungen kostet Energie.¶
Wie aber kann in einer chemischen Reaktion Energie frei werden, wenn das Brechen von Bindungen doch Energie braucht? Indem schwache Bindungen gebrochen und starke geknüpft werden. Das folgende Diagramm zeigt die Idee - aber du brauchst das hier noch nicht zu verstehen, auf der nächsten Seite wird dies erklärt.
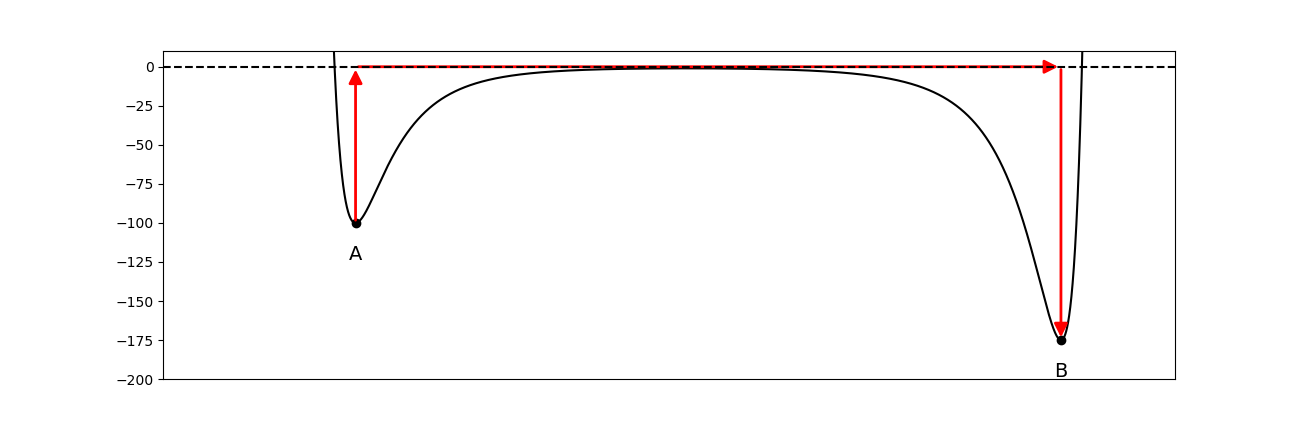
Abb 8: Das Molekül mit Kernabstand A wird gespalten und ein Molekül mit Kernabstand B (von rechts gemessen) entsteht.¶
Schlage nun ein paar Bindungsenergien in einer Tabelle nach. Bindungsenergien werden oft Bindungsenthalpien genannt und unter diesem Namen aufgeführt. Der Begriff “Bindungsenthalpie” ist ein sehr technischer Begriff und im letzten Abschnitt erfährst du dazu mehr.
In der Tabelle suchst du den einen Bindungspartner in den Spaltenüberschriften, den anderen seitlich und am Kreuzungspunkt findest du die Bindungsenthalpie. Für FH-Bindungen findest du die Bindungsenergie also so:
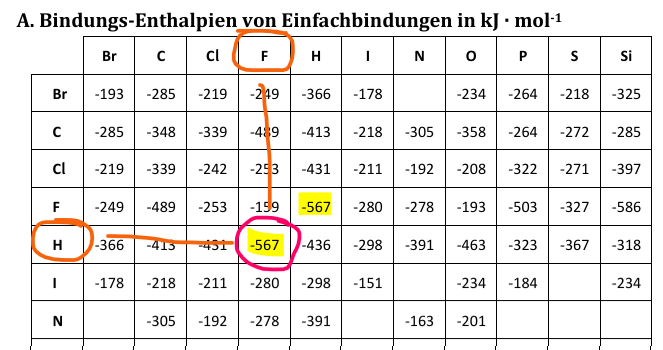
Abb 9: Bindungsenergien in der Tabelle nachschlagen¶
Die Bindungsenergie von Bindungen zwischen zwei Wasserstoffatomen beträgt (pro mol Bindungen): kJ/mol
Die Bindungsenergie von anderen Bindungen können viel grösser oder auch kleiner sein. Die Bindungsenergie der H-F-Bindungen beträgt kJ / mol
Einfach und Mehrfachbindungen haben natürlich nicht dieselbe Bindungsenergie. Die Bindungsenergie der Mehrfachbindung in Stickstoff-Molekülen beträgt kJ / mol
Wie viel Energie wird also benötigt, um ein mol Wassermoleküle in einzelne Atome zu zerlegen?
Hinweise:
- jedes Wassermolekül weist zwei OH-Bindungen auf
- Um Bindungen zu spalten, muss man Energie in das System hineinstecken
1.1. Bindungsenergien sind nur ungefähre Grössen¶
Zum Schluss dieser Seite noch eine Bemerkung: Bindungsenergien stimmen für gegebene Bindungen nur ungefähr. Denn Bindungen zwischen denselben Atomen können sehr unterschiedlich stark sein, je nachdem, in welcher Umgebung sie sich befinden (Abb. 1). Dennoch stimmen die Werte oftmals recht genau.
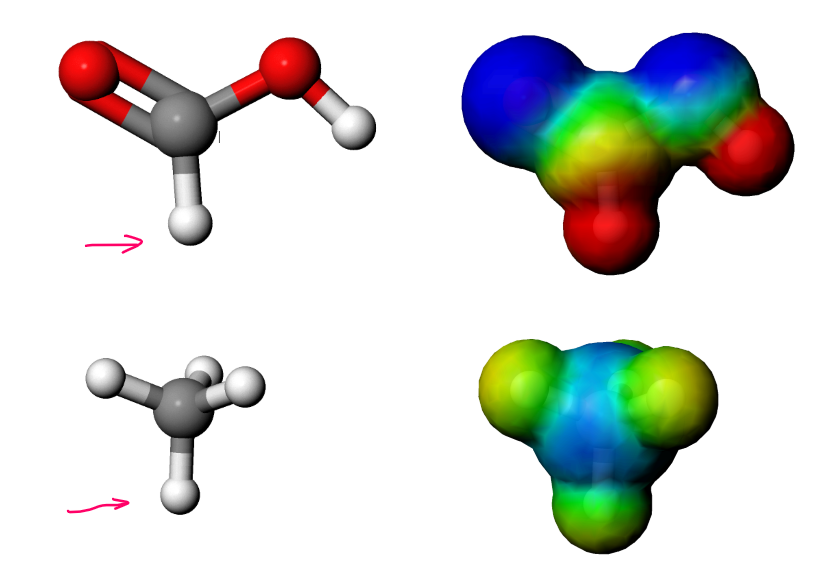
Abb 10: Unterschiedlich gebundene H-Atome in CH-Bindungen. Das H-Atom in der Methansäure trägt eine recht positive Partialladung, weil die beiden stark elektrophilen O-Atome die Valenzelektronen “absaugen”. Die C-H-Bindungen in diesen Molekülen weisen daher unterschiedliche Bindungsenergien auf.¶
Weiter zur nächsten Seite
Zurück zum Start
Zurück zum Molekularium