7. Energie und Enthalpie¶
Bei vielen chemischen Reaktionen spielt der Luftdruck eine Rolle.

Abb 1: Die Luft drückt auf Reaktionssysteme und beeinflusst sie.¶
Bei der Elektrolyse von Wasser enstehen beispielsweise zwei Gase. Nicht nur kostet die Umwandlung von Wassermolekülen in Sauerstoff- und Wasserstoffmoleküle Energie. Die entsehenden Gase nehmen zudem mehr Raum ein und müssen sich gegen den Luftdruck ausdehen. Auch das kostet Energie.
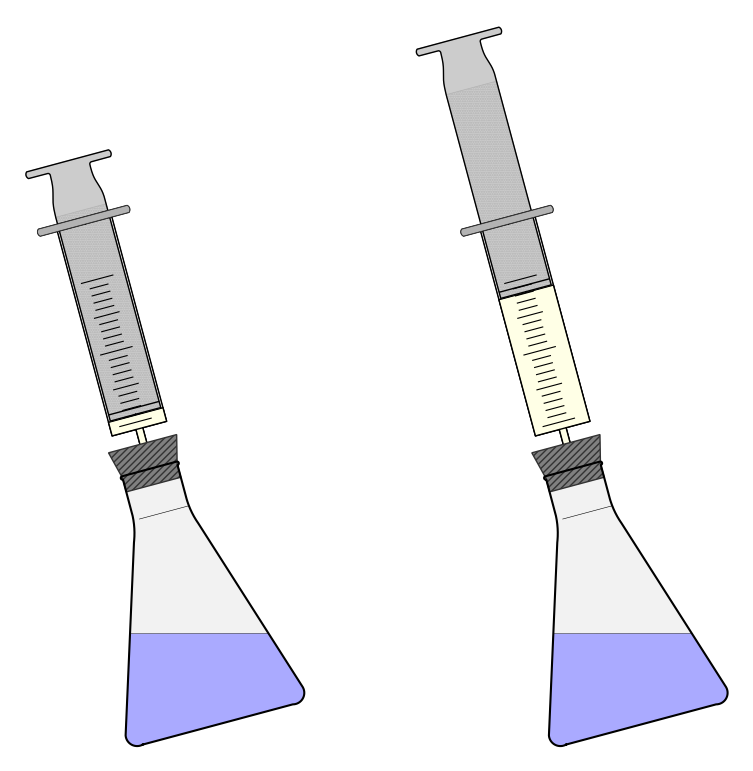
Abb 2: Wenn in einer Reaktion ein Gas entsteht, muss sich dieses gegen den Luftdruck ausdehnen und das kostet Energie.¶
Bei chemischen Reaktionen in offenen Gefässen muss man diesen Einfluss des Luftdrucks stets einberechnen. Genau dazu ist die Enthalpie gut: Bei Reaktionsenthalpien ist der Einfluss des Luftdrucks stets schon einberechnet. Enthalpie ist also eine ziemlich komplizierte Grösse, es ist die Reaktionsenergie plus der Einfluss des Luftdrucks.
Take home Message: Wenn man über Energien spricht, muss man sich immer genau überlegen, was man genau misst, welche Energie-Anteile man berücksichtigt und welche man vernachlässigt. Der technische Begriff „Enthalpie“ definiert dies klar und eindeutig.
Wir müssen uns darüber allerdings keine Gedanken machen. Wir können mit Enthalpien rechnen, als wären es ganz normale Energien, und uns darüber freuen, dass bei den Berechnungen dann der Effekt des Luftdrucks automatisch immer schon mit eingerechnet ist.
Wer die Details genau wissen möchte: Man berechnet die Enthalpie eines Systems aus der Energie in diesem System (Innere Energie U), dem Volumen des Systems V und dem Luftdruck p nach der Formel:
\(H = U + p \cdot V\)
Zurück zum Start
Zurück zum Molekularium