2. Was bestimmt die Grösse der Bindungsenergie?¶
2.1. Faktoren¶
Die Bindungsenergie hängt vor allem von drei unabhängigen Faktoren ab: Von der Länge der Bindung, von der Anzahl der Bindungselektronen und von der Polarität der Bindung. In diesem Abschnitt werden wir nur untersuchen, wie sich diese Faktoren auswirken. Falls dich interessiert, weshalb sich diese Faktoren auf die Bindungsenergie auwirken, findest du am Ende dieser Seite Hintergrundinfos.
2.1.1. Erster Faktor¶
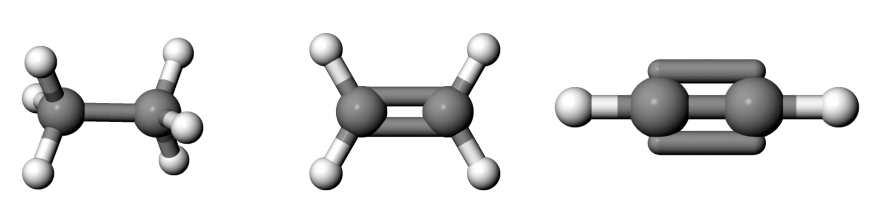
Abb 1: Ethan, Ethen und Ethin.¶
Der erste Faktor wird klar, wenn man die CC-Bindungen in Ethan, Ethen und Ethin vergleicht.
Molekül |
Ethan |
Ethen |
Ethin |
|---|---|---|---|
Bindungsenergie [kJ/mol] |
-348 |
-614 |
-839 |
Der Faktor, welcher hier zu stark unterschiedlichen Bindungsenergien führt, ist
.
Diese Bindungen sind umso stärker (die Bindungsenergie ist umso stärker negativ bzw. ihr Betrag ist umso grösser), je
.
2.1.2. Zweiter Faktor¶
Der zweite Faktor zeigt sich, wenn man folgende Bindungen vergleicht:
Bindung |
Cl-Cl |
Br-Br |
I-I |
|---|---|---|---|
Bindungsenergie [kJ/mol] |
-242 |
-193 |
-151 |
Der Faktor, welcher hier zu stark unterschiedlichen Bindungsenergien führt, ist
.
Diese Bindungen sind umso stärker (die Bindungsenergie ist umso stärker negativ bzw. ihr Betrag ist umso grösser), je
.
2.1.3. Dritter Faktor¶
Den dritten Faktor erkennt man, wenn man folgende Bindungen vergleicht:
Bindung |
HN-Bindung |
HO-Bindung |
HF-Bindung |
|---|---|---|---|
Bindungsenergie [kJ/mol] |
-391 |
-463 |
-567 |
Näherungsweise kann du annehmen, dass die Atome N, O und F alle etwa gleich gross sind.
Der Faktor, welcher hier zu stark unterschiedlichen Bindungsenergien führt, ist
.
Diese Bindungen sind umso stärker (die Bindungsenergie ist umso stärker negativ bzw. ihr Betrag ist umso grösser), je
.
Welchen Zahlenwert benutzt man, um die Grösse dieses Faktors abzuschätzen?
.
Wie gross ist dieser Zahlenwert für diese drei Bindungen? Gib die Werte (mindestens) auf eine Nachkommastelle gerundet ein.
| Bindung | Zahlenwert |
|---|---|
| HN-Bindung | |
| HO-Bindung | |
| HF-Bindung |
Übrigens: Für diese Faktoren gibt es Ausnahmen, die sich aber mit den Hintergrundinfos verstehen lassen. Findest du solche Ausnahmen?
2.2. Beispiel¶
Betrachte nun zwei Bindungen: eine C-H und eine C-Cl-Einfachbindung. Was spricht dafür, dass die C-Cl-Einfachbindung eine höhere Bindungsenergie hat und was dafür, dass sie die tiefere Bindungsenergie hat?
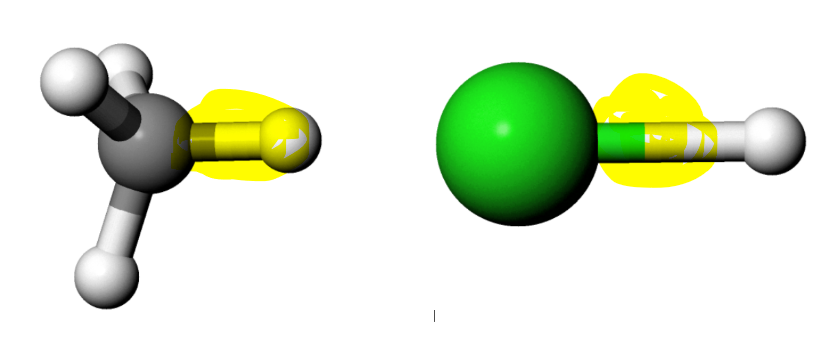
Abb 2: Die Bindungsenergien einer CH- und einer ClH-Bindung werden verglichen.¶
Dafür, dass die Bindung zwischen Chlor- und Wasserstoffatomen (H-Cl) stärker ist als die C-H-Bindung (stärker negative Bindungsenergie), spricht, dass die Bindung
.
Dafür, dass die H-Cl-Bindung schwächer ist, spricht, dass die Bindung
ist.
Welches Atom trägt die negative Partialladung in der C-H-Bindung
und in der HCl-Bindung?
2.3. Hintergrund¶
Doch weshalb sind kurze, stark polare Mehrfachbindungen besonders schwer zu zerreissen? Alle diese Faktoren haben irgendwie damit zu tun, dass sich die Elektronen und Rümpfe in Molekülen mit solchen Bindungen besonders stark gegenseitig anziehen.
2.3.1. Elektronen pro Bindung¶
Der am einfachsten verständliche Faktor ist die Anzahl der Elektronenpaare in der Bindung: Eine Doppelbindung ist stärker als eine Einfachbindung, weil zusätzlich zur σ-Bindung auch noch eine π-Bindung hinzukommt. Daher ist die Reaktionsenergie stärker negativ. Bei einer Dreifachbindung kommt noch eine weitere π-Bindung hinzu, und so ist es nicht erstaunlich, dass die Bindungsenergie von Dreifachbindungen besonders stark negativ ist.
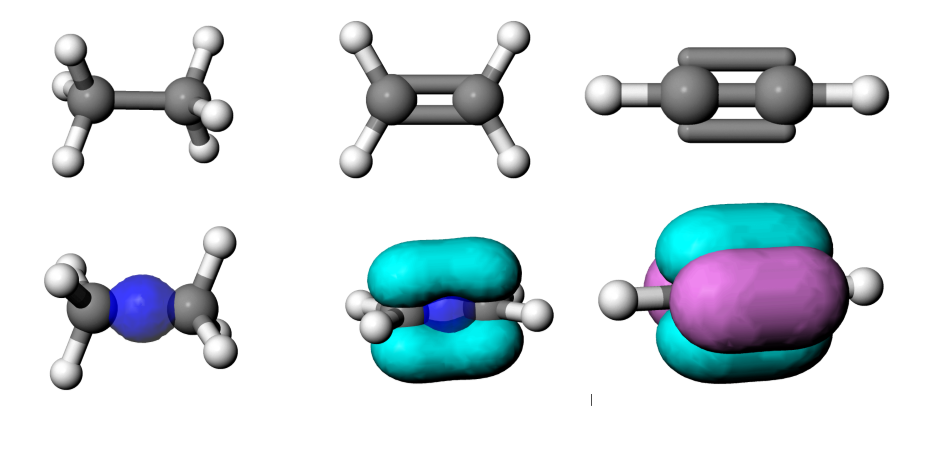
Abb 3: Bindungen in Ethan, Ethen und Ethin¶
Interessant wird es, wenn man überprüft, wie gross der Effekt der zusätzlichen Bindungselektronenpaare ist. Im einfachsten Fall würde jedes Elektron die Bindungsenergie um denselben Betrag senken.
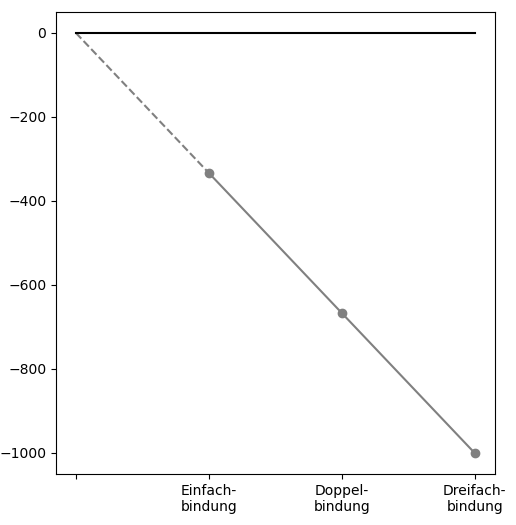
Abb 4: Einfachster Fall für den Effekt der Anzahl Bindungselektronenpaare¶
So einfach ist es aber nicht. Man könnte sodann vermuten, dass die π-Bindungen einen kleineren Beitrag leisten, weil sie eine grössere Distanz zu den Rümpfen aufweisen - aber auch das ist nicht immer so. Der Effekt ist von Atomsorte zu Atomsorte recht verschieden, je nach der genauen elektronischen Struktur. Dies hat wichtige Auswirkungen auf das Leben - siehe den Abschnitt über die Stabilität organischer Stoffe.
2.3.2. Bindungslänge¶
Der zweite Faktor ist auch einfach zu verstehen. Chlor und Fluor-Moleküle sind identisch aufgebaut: um zwei 7-Fach geladene Rümpfe gruppieren sich insgesamt 7 doppelt gefüllte Kugelwolken. Sie unterscheiden sich einzig darin, dass das Chloratom mehr Rumpfelektronen enthält und damit einen grösseren Rumpf aufweist. Daher sind die Elektronen etwas weiter weg von der positiven Ladung und werden selber auch noch etwas grösser. Alle Bestandteile sind also etwas grösser, die Abstände zwischen Elektronen und Rümpfen sind etwas grösser, und so sind die Coulomb-Anziehungskräfte kleiner. Daher hält die Bindung schlechter und die Bindungsenergie ist weniger stark negativ.
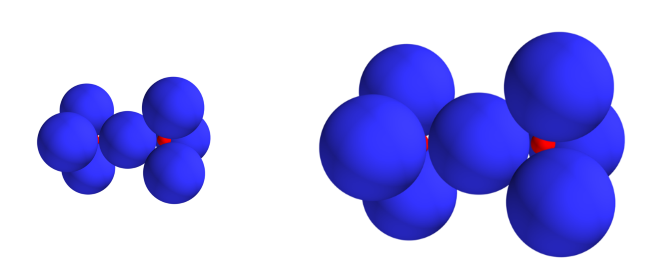
Abb 5: Fluor und Chlor im Ladungswolkenmodell¶
2.3.3. Bindungspolarität¶
Der kniffligste Einflussfaktor ist die Bindungspolarität. Wieso sollten Bindungen umso stärker sein, je polarer sie sind?
Dies hat damit zu tun, dass polare Bindungen etwas kürzer sind als vergleichbare weniger polare Bindungen. In folgender Abbildung sind Chlor-, Fluor- und Wasserstoffatome in verschiedenen Molekülen zu sehen. Ihr Radius entspricht immer ihrem Kovalenzradius. Während die Atome sich in den Elementarstoffmolekülen stets gerade berühren, überlappen sie in den Verbindungen mit polaren Bindungen. Dies bedeutet, dass der Kernabstand in polaren Bindungen etwas kürzer ist als die Summe der Kovalenzradien.
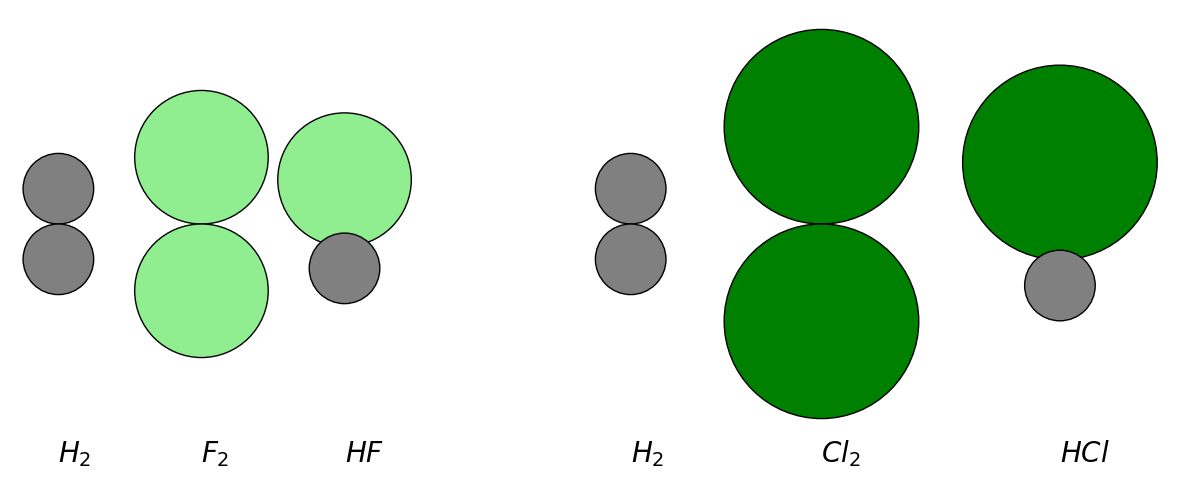
Abb 6: Polare Bindungen sind etwas kürzer als vergleichbare unpolare Bindungen.¶
In einer Bindung zwischen schwach elektronegativen Atomen (z.b. zwei Silicium-Atome) wird das bindende Elektronenpaar schwach festgehalten, weil die Rumpfladung schwach ist. Daher lässt sich die Bindung relativ gut zerreissen.
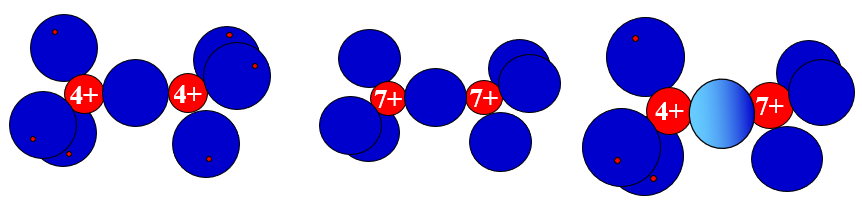
Abb 7: Unpolare und polare Bindungen im Kugelwolkenmodell: \(Si_2H_6\), \(Cl_2\), \(ClSiH_3\)¶
Aber auch die Bindung zwischen zwei stark elektronegativen Atomen ist schwach. Hier würden die Bindungselektronen zwar stark von den stark geladenen Rümpfen angezogen, aber die Rümpfe stossen sich gegenseitig stark ab, so dass die Bindung ebenfalls relativ lang bleibt und die Elektronen vergleichsweise schwach gebunden werden.
In einer polaren Bindung werden die Elektronen hingegen vom elektronegativeren Atom stark angezogen. Der Rumpf des anderen Atoms ist zu schwach geladen, um eine starke Abstossung zu erfahren. Alle Valenzelektronen können also näher zum stark geladenen Rumpf hin rücken und werden von diesem stark angezogen, was zu hohen Anziehungskräften führt. Daher sind polare Bindungen schwer zu zerreissen und haben eine stark negative Bindungsenergie.
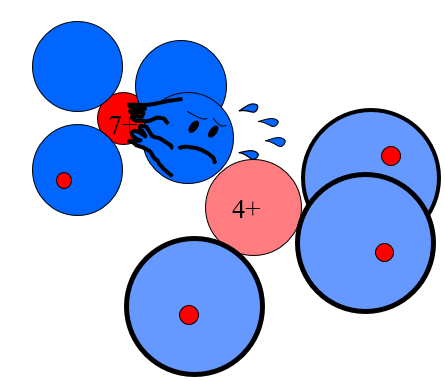
Abb 8: Bindungselektronenpaar in einer stark polaren Bindung.¶
Weiter zur nächsten Seite
Zurück zum Start
Zurück zum Molekularium