4. Knacknüsse zur Reaktionsenergie¶
In der Biochemie ist es oft erforderlich abzuschätzen, ob eine Reaktion spontan abläuft und dabei Energie freisetzt oder ob Energie zugeführt werden muss, damit sie statt-findet. Die Faustregel auf der vorherigen Seite ist hier hilfreich:
Faustregel 1
Bindungen sind in der Regel umso stärker, je polarer sie sind. Wenn in einer Reaktion schwach polare Bindungen zu stark polaren umgesetzt werden, wird daher normalerweise Energie frei und die Reaktion läuft spontan (von selber) ab.
Für quantitative Abschätzungen können wir die Faustregel noch etwas ergänzen:
Faustregel 2
In grober Näherung liefert jede CC- oder CH-Bindung beim Verbrennen pro Bindungselektronenpaar ganz grob etwa 220 kJ/mol Energie. Durch das Umsetzen stark polarer Bindungen wird hingegen in grober Näherung keine Energie frei.
4.1. Ethanol und Benzin¶
Sowohl Ethanol als auch Benzin werden verwendet, um Motoren anzutreiben. Benzin ist ein kompliziertes Gemisch von Alkanen, aber wir nehmen hier einfachheitshalber an, es bestehe nur aus Octan.

Abb 1: Tankstellen mit Ethanol und mit Benzin¶
Pro kg enthält Octan viel mehr Energie als Ethanol. Dies kann man anhand folgender Abbildung verstehen.
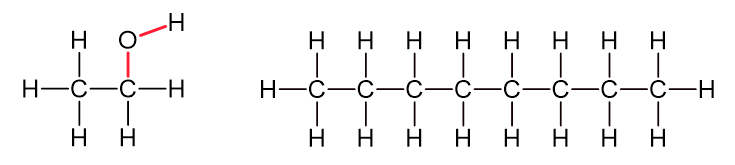
Abb 2: Ethanol und Octan. Alle stark polaren Bindungen sind rot dargestellt, die schwach polaren oder unpolaren schwarz.¶
Octan enthält nur schwach polare oder unpolare Bindungen. Beim Verbrennen liefert jede einzelne dieser Bindungen Energie, weil ihre Spaltung wenig Energie kostet und die entstehenden OH- und CO-Bindungen viel Energie liefern.
Ethanol enthält hingegen bereits ein polar gebundenes O-Atom. Die zwei stark polaren Bindungen zu diesem Atom sind bereits energetisch günstig und liefern beim Verbrennen keine Energie. Das O-Atom ist bezüglich Energiedichte nur Ballast: Es macht das Molekül zwar schwerer, trägt aber nichts zum Energiegehalt bei.
Wie viel Energie ergibt gemäss dieser Abschätzung die Verbrennung von Ethanol und von Octan?
| Reaktionsenergie | |
|---|---|
| Abgeschätzte Reaktionsenergie der Verbrennung von Ethanol | kJ/mol |
| Abgeschätzte Reaktionsenergie der Verbrennung von Octan | kJ/mol |
Zum Vergleich: Folgende Tabelle zeigt die genauen Messwerte dieser Reaktionsenergie und daneben die Werte, die man mit der obigen Berechnungsmethode erhält. Auch die grobe Abschätzung mit 220 kJ/mol polare Bindungen stimmt in diesen Fällen sogar genauer als die Berechnung mit Bindungsenergien!
Gemessener Wert |
Aus Bindungsenergien berechnet |
|
|---|---|---|
Ethanol |
1367.6 kJ/mol |
-1030 kJ/mol |
Octan |
-5430 kJ/mol |
-4159 kJ/mol |
Bitte überlege dir die Antworten auf folgende Fragen zuerst alleine und notiere deine Antwort, bevor ihr euch im Zweier- oder Dreierteam über eure Antwworten austauscht.
4.2. Fett und Zucker¶
Folgende Abbildung zeigt ein Zuckermolekül (Glucose) und ein Fettmolekül (Glycerintripalmitat). Im Fett sind alle polaren Bindungen rot eingezeichnet, die unpolaren schwarz.
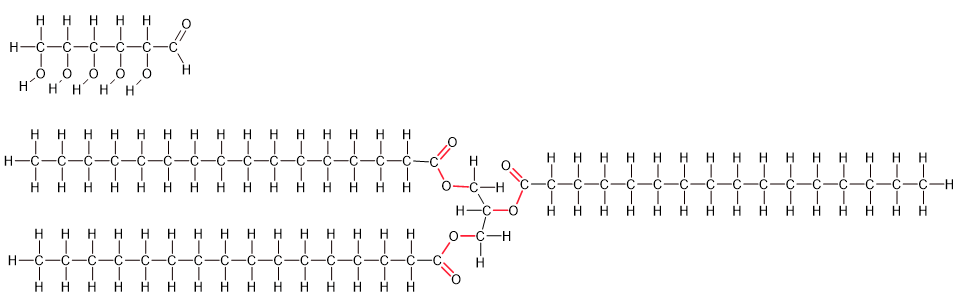
Abb 3: Glucose und Fett. Die molaren Massen von Glucose und Glycerintripalmitat betragen 180.16 g/mol bzw. 807.33 g/mol.¶
Versuche anhand von Bindungs- und Reaktionsenergien zu erklären, weshalb Zugvögel fast nur Fett als Energiespeicher verwenden und kaum Zucker, während Pflanzen ihre Energie meist in Form von Zucker und anderen Kohlenhydraten speichern (wie Stärke).

Abb 4: Zugvögel verwenden vor allem Fett als Energiespeicher, viele Pflanzen hingegen Kohlenhydrate wie Zucker und Stärke¶
4.3. Reaktionsenergie der Verbrennung von Fett¶
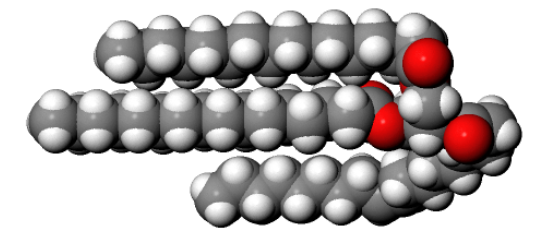
Abb 5: Fettmolekül (Glycerintripalmitat)¶
Schätze nun die Reaktionsenergie der Verbrennung von Glucose und dem obigen Fett mit Hilfe unserer Faustregel (-220 kJ/mol schwach oder unpolare Bindung) an.
Bei Glucose könnte man die schwach- oder unpolaren Bindungen an sich noch durchzählen. Aber es geht einfacher:
Zählen wir die Valenzelektronen, die insgesamt für Bindungen zur Verfügung stehen.
pro C-Atom 4 Valenzelektronen
pro H-Atom 1 Valenzelektron
pro O-Atom 2 Valenzelektronen für Bindungen (die übrigen 4 sind ja in nichtbindenden Elektronenpaaren verstaut)
Insgesamt stehen also 48 Elektronen für Bindungen zur Verfügung. Das gibt 48/2 = 24 Elektronenpaarbindungen. Jedes O-Atom geht aber nur stark polare Bindungen ein und pro O-Atom sind dies 2 Bindungselektronenpaare, total also 12 Bindungselektronenpaare. Es verbleiben somit 12 Elektronenpaare in unpolaren Bindungen. Glucose sollte also beim Verbrennen etwa \(12 \cdot -220\ kJ/mol = -2640 kJ/mol\) liefern.
Schätze auf dieselbe Weise ab, wie gross die Reaktionsenergie der Verbrennung des Fettes etwa ist. Es hat die Formel \(C_{51}H_{98}O_6\) und den Namen Glycerin-Tripalmitat.
Glucose hat eine molare Masse von 180.16 g/mol, Glycerin-Tripalmitat eine molare Masse von 807.33 g/mol. Berechne zudem, wie viele kJ pro Gramm in diesen beiden Stoffen gespeichert sind. Verwende dazu die Zahlen aus deinen groben Abschätzungen (mit 220 kJ/mol pro schwach polarer Bindung).
| Reaktionsenergie | |
|---|---|
| Abgeschätzte Reaktionsenergie der Verbrennung des Fettes | kJ/mol |
| Pro Gramm etwa gespeicherte Energie in Zucker (als negative Zahl) | kJ/g |
| Pro Gramm etwa gespeicherte Energie in Fett (als negative Zahl) | kJ/g |
Ein Gramm Fett speichert also etwa doppelt so viel Energie wie ein Gramm Zucker!
4.4. Wie lang reicht 1 g Essen?¶
Berechne aus diesen Werten selbst eine Faustregel:
Wie lange etwa lebt ein ruhender Mensch von 1 g Zucker oder von 1 g Fett? (oder anders gefragt, wie lange dauert es, bis 1 g Körperfett verbraten sind?). In Ruhe verbrauchen wir etwa 100 W Energie, bei Schwerstarbeit verbrauchen wir etwa 400 W und leisten 100 W körperliche Arbeit.
4.5. Wie viel Zucker braucht ein:e Diabetiker:in?¶
Diabetiker messen den Blutzuckergehalt in mmol/L. Normal ist ein Zuckergehalt von 3.3 bis 5.6 mmol/L. Wie viel Zucker benötigt ein Diabetiker mit einem gefährlichen Blutzucker von 2 mmol/L, um auf 6 mmol/L zukommen? Der Zucker verteile sich auf etwa 30 Liter Körperflüssigkeit (Blut, Lymphe, Zellplasma,…)

Abb 6: Diabetes¶
4.6. Der perfekte Treibstoff¶
Versucht, folgende Frage anhand von abgeschätzten Reaktionsenergien zu beantworten - zuerst alleine und dann im Team.
Motoren kann man mit ganz verschiedenen Treibstoffen betreiben, zum Beispiel mit
Wasserstoff, \(H_2\)
Erdgas (vorwiegend Methan, \(CH_4\))
Benzin (im Durchschnitt etwa \(C_8H_{18}\))
Kohle, \(C\)
Daniela Düsentrieb erfindet gerade ein Flugzeug, das man für wenig Geld im Internet bestellen und selber zusammenbauen kann und das dann trotzem mit möglichst wenig Treibstoff möglichst weit fliegt. Welches ist aus ihrer Sicht der beste Treibstoff? Was wäre der zweitbeste?
Und Lars Eisbär darf auswählen, mit welchen zwei Treibstoffen die Menschen in Zukunft ihre Energie gewinnen sollen. Was ist aus seiner Sicht der beste und der zweitbeste Treibstoff?
Tipp: Was bedeutet “gut” für Daniela Düsentrieb und was heisst “gut” für Lars Eisbär?

Abb 7: Daniela Düsentrieb und Lars Eisbär¶
4.7. Rakete¶

Abb 8: Die Rakete…¶
Und wie viel Treibstoff braucht nun eine Rakete, um der Erde zu entkommen?
Dafür brauchst du nun nur noch die Formel, mit der du die potentielle Energie der Rakete auf der Erdoberfläche und im Weltall berechnen kannst:
\(E_{pot} = -G \frac{m_1 \cdot m_2}{r}\)
Wobei
\(G\) = Gravitationskonstante = \(6.67 \cdot 10^{-11} \frac{Nm^2}{kg^2}\)
\(m_1\) = Masse der Rakete (Vorschlag: baue eine Minirakete mit einer Masse von 1000 kg)
\(m_2\) = Masse der Erde = \(5.976 \cdot 10^{24} kg\)
\(r\) = Abstand der Rakete vom Mittelpunkt der Erde. Auf der Erdoberfläche sind das etwa 6’380’000 m, im Weltall beliebig gross.
Man darf - wie in der Chemie - allerdings keine Angst vor negativen Energien haben 😊.
Ja, und während Daniela Düsentrieb natürlich keinen flüssigen Wasserstoff erzeugen konnte wegen seines enormen Drucks, kannst du hier durchaus flüssigen Wasserstoff verwenden.
Good luck!
Ah, und wenn das Resultat etwas unplausibel erscheint: Vergiss nicht, dass die Rakete den meisten Treibstoff verliert, bis sie ganz oben ist.
Weiter zur nächsten Seite
Zurück zum Start
Zurück zum Molekularium