2. Sulfanilamid: Antibiotikum mit Nebenwirkungen¶
2.1. Sulfanilamid hemmt gleich mehrere Enzyme¶
Sulfanilamid Abbildung 2.1 zeigt interessante medizinische Eigenschaften. Einerseits hemmt es das Wachstum von Bakterien und lässt sich daher als Antibiotikum verwenden. Andererseits wirkt es auf unterschiedliche Weise auf den menschlichen Körper, so fördert es die Urinausscheidung (Diuretikum), senkt den Augendruck oder bringt Patienten dazu, schneller und tiefer zu Atmen.
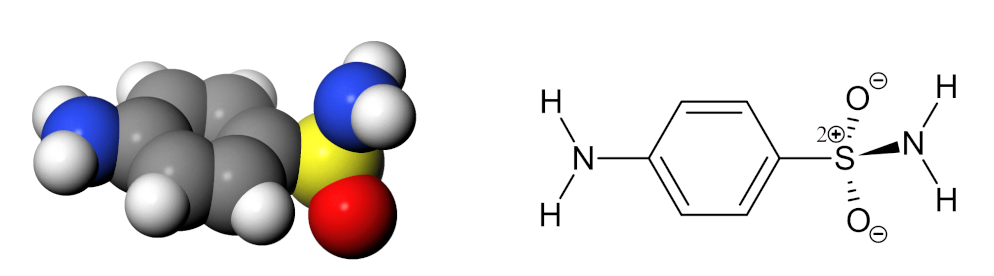
Abb 2.1. Kalottenmodell und Strukturformel von Sulfanilamid¶
Ein sehr nützliches Molekül also - wenn es nicht stets alle diese Wirkungen miteinander entfalten würde. Aber meistens ist nur eine der Wirkungen erwünscht - die wenigsten Patienten brauchen gleichzeitig ein Antibiotikum, ein Diuretikum und ein Mittel gegen erhöhten Augendruck… Welche Wirkung auch immer erzielt werden soll - die anderen Wirkungen sind stets unerwünschte oder gar gefährliche Nebenwirkungen.
Die meisten dieser Wirkungen kommen zustande, indem Sulfanilamid an zwei Enzyme bindet und sie dadurch hemmt. Das eine dieser Enzyme ist die bakterielle Dihydropteroat-Synthase (DHPS). Dadurch wirkt Sulanilamid bakteriostatisch (hemmend auf das Wachstum von Bakterien). Das andere Enzym ist die menschliche Carboanhydrase (CA).
Sulfanilamid bindet an beide Enzyme recht gut. Es zeigt sich aber, dass beide Enzyme das Molekül auf völlig unterschiedliche Weise binden. Die Stelle, die beim einen Enzym tief in der Bindetasche steckt, schaut beim anderen Enzym aus dem Protein heraus in die Lösung. Abbildung 2.2 stellt diesen Sachverhalt sehr schematisch dar.
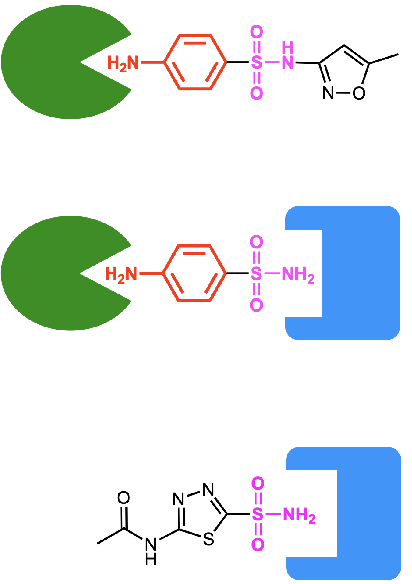
Abb 2.2. Schematische Darstellung von Sulfanilamid (Mitte) und zwei anderen Sulfonamiden als Inhibitoren der der Dihydropteroatsynthase (DHPS, grün) und der Carboanhydrase (CA, blau). Sulfanilamid in der Mitte kann sowohl an die DHPS und CA binden und blockiert dadurch beide Enzyme. Das obere Sulfonamid bindet nur an die DHPS. Dieses Molekül ist ein Antibiotikum mit wenigen Nebenwirkungen. Das unterste Sulfonamid wiederum bindet nur an die CA und wirkt daher nicht antibiotisch.¶
Das Schema deutet auch bereits an, wie man diese Tatsache ausnützen kann, um spezifischere Antibiotika oder Medikamente zu entwickeln. Man kann das Molekül spezifischer machen, indem an es um zusätzliche Gruppen erweitert. Aber ganz so einfach, wie das Schema es andeutet, sind die Verhältnisse nicht: Die meisten Veränderungen des Moleküls ergeben nämlich neue Moleküle, die an keines der Enzyme mehr binden.
2.2. Aufgabe¶
Auf dieser Seite geht es darum, wie es Sulfanilamid schafft, an die beiden Enzyme zu binden.
In einer späteren Aufgabe soll dann mit Hilfe der gewonnenen Erkenntnisse ein Inhibitor untersucht werden, der nur noch an eines der beiden Enzyme bindet und daher ein gutes, nebenwirkungsarmes Antibiotikum darstellt.
Zum Schluss sollen aus einer Serie von Molekülen diejenigen ausgewählt werden, die nur noch an eines der beiden Enzyme binden, die also dieses Enzym spezifisch blockieren. Auf diese Weise soll ein Antibiotikum gefunden werden, das kaum Nebenwirkungen zeigt, oder umgekehrt ein Medikament ohne antibiotische Wirkung.
Durch Docking wird dann ausprobiert, ob die Auswahl korrekt war.
2.3. Bindung von Sulfanilamid an DPHS und CA¶
Sie werden in dieser Aufgabe untersuchen, auf welche Weise Sulfanilamid an DPHS und CA bindet. In Abbildung 2.3 können Sie die Ergebnisse festhalten. Sie stellt immer wieder dasselbe Molekül dar, Sulfanilamid, aber in verschiedenen Orientierungen. Drucken Sie die Abbildung aus oder halten Sie sie z.B. in Onenote zum Skizzieren bereit.
In einem nächsten Schritt werden Sie diese Skizzen benötigen, um ein geeignetes Antibiotikum ohne Nebenwirkungen zu entwickeln, oder um ein Diuretikum zu finden, das keine Bakterien abtötet.
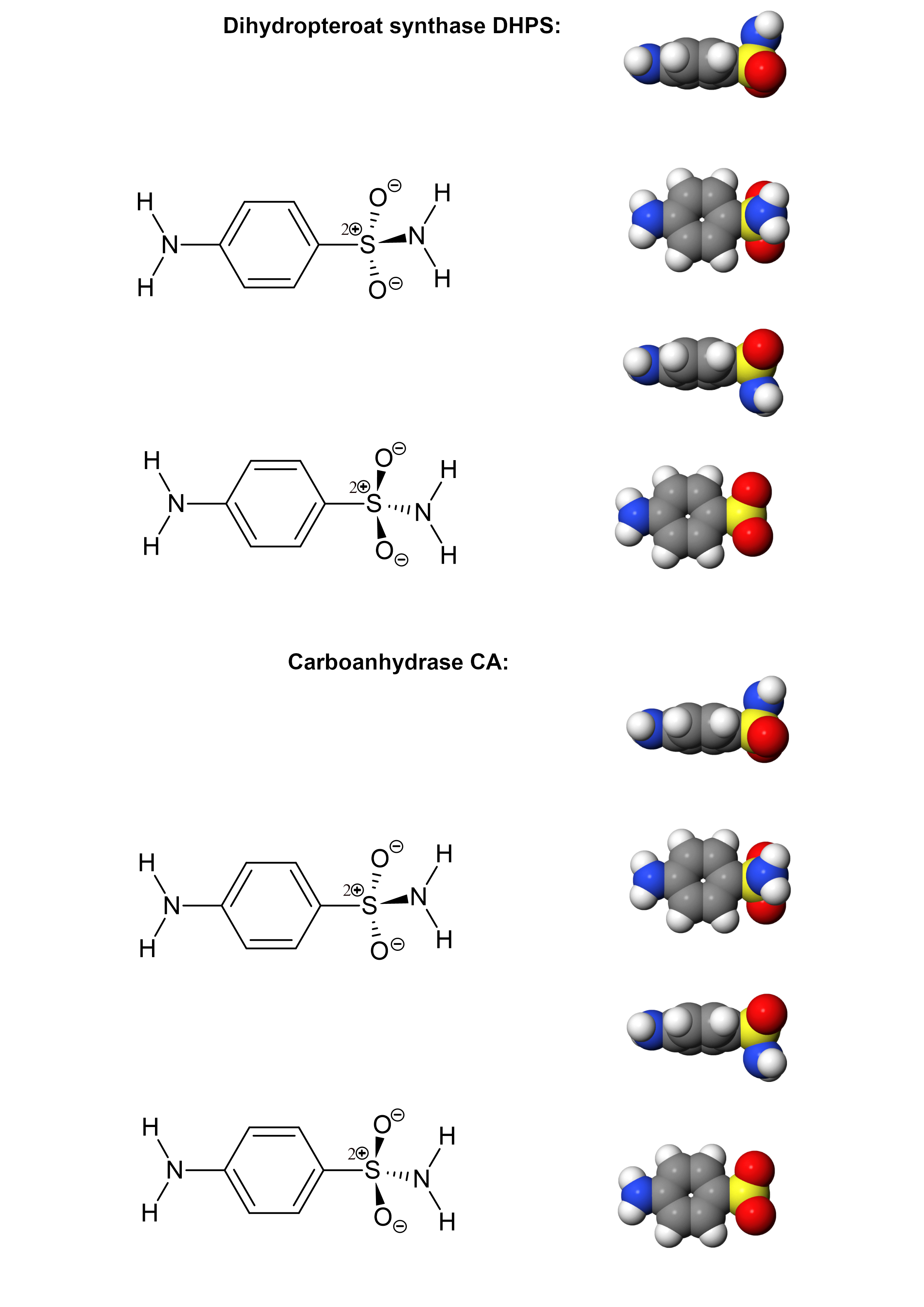
Abb 2.3. Abbildung zur Darstellung der Wechselwirkungen zwichen Sulfanilamid und den Enzymen DHPS und CA¶
Ein guter Inhibitor sollte möglichst viele starke zwischenmolekularen Wechselwirkungen mit dem zu blockierenden Enzym eingehen. Zudem sollten möglichst wenige räumliche Behinderungen zwischen dem Enzym und dem Inhibitor auftreten. Wenn ein Enzym durch das Molekül nicht blockiert werden soll, ist es genau umgekehrt: Es sollten dann möglichst wenige bindende Wechselwirkungen auftreten und je schlechter das Molekül in die Enzymtasche passt, desto besser.
Achten Sie sich also besonders auf folgende Aspekte und halten Sie sie in der Skizze fest. Verwenden Sie den oberen Teil der Abbildung für das eine Enzym, den anderen für das andere. Scheiben Sie an, welches bei Ihnen das obere und welches das untere Enzym ist:
Zwischenmolekulare Wechselwirkungen.
Welche Wasserstoffbrücken geht das Molekül in den beiden Enzymen ein? Zeichnen Sie die Wasserstoffbrücken in den Lewisformeln ein.
Welche Van der Waals-Wechselwirkungen (Dispersions-Wechselwirkungen) herrschen zwischen Enzym und Sulfanilanmid? Schraffieren sie über der Lewis-Formel diejenigen hydrophoben Bereiche, die in Kontakt mit hydrophoben Enzym-Bereichen sind.
Treten Ionenbindungen oder Wechselwirkungen zwischen ionischen Gruppen und Partialladungen auf? Deuten Sie negative und positive Ladungen mit der entsprechenden Farbe an.
Sterische (räumliche) Unterschiede
Wo befindet sich das Molekül in einer Bindungstasche und wo berührt es die Lösung? Zeichnen sie über die Kalottenmodelle den ungefähren Verlauf des Randes des Enzyms. Schraffieren Sie Bereiche, die im Inneren des Enzyms verborgen sind.
Wenn man bei Sulfanilamid eine Gruppe erweitert, die ins Enzym eingepasst ist, wird das Molekül nicht mehr an das Enzym binden. Wenn es hingegen an einer Stelle vergrössert wird, die aus dem Protein heraus ragt, wird dies die Stärke der Bindung kaum beieinträchtigen.
Mit Hilfe dieser Aufgabe können dann Fragen angepackt werden wie: Wo bestehen also Unterschiede zwischen den Enzymen? Welche Stelle, die tief im einen Enzym verborgen ist, ist beim anderen Enzym zugänglich? Wo könnte man Sulfanilamid wie verändern, damit es nur noch eines der beiden Enzyme bindet?
Informationen zu den dargestellten Proteinen
Dihydropteroat-Synthase DHPS
Von der DHPS von Yersinia pestis existieren schöne röntgenkristallographische Aufnahmen mit Sulfamethoxazol (3TZF) und dem natürlichen Substrat p-Aminobenzoesäure pABA, zusammen mit einem Analogon des Überganszustandes 2-amino-6-methylidene-6,7-dihydropteridin-4(3H)-on (XHP) (3TYZ) [1].
Die einzige Struktur mit Sulfanilamid (1AJ0 aus E. coli) ist weniger genau, zudem fehlt in E. coli eine Struktur mit pABA. Daher wurde für diese Seite das Enzym mit Sulfamehtoxazol verwendet (3TZF) und das Sulfamethoxazol abgeändert zu Sulfanilamid.
Carboanhydrase
Dargestellt wird die Struktur 6RL9 (pdb)
2.3.1. Vorgehen mit dem interaktiven Modell¶
Tipp: Drucken Sie sich die Anleitung aus (Word- und pdf-Dateien sind zuunterst auf dieser Seite verlinkt). Wenn Sie einen genug grossen Bildschirm haben, können Sie diese Seite auch zwei mal nebeneinander öffnen. Schieben Sie die eine Seite schmal zusammen und machen Sie die andere möglichst breit und scrollen nach unten bis zur interaktiven Abbildung. Auf der schmalen Seite können Sie dann diese Anleitung verfolgen, auf der breiten arbeiten.
Ganze Anleitung expandieren minimierenWählen Sie zuerst mit den oberen Knöpfen ([Dihydropteroat synthase (DPHS) mit Sulfanilamid] bzw. [Carboanhydrase (CA) mit Sulfanilamid]) eines der beiden Enzyme mit gebundenen Sulfanilamid.
Schalten Sie nun mit dem rechten Knopf [weitere Tools] das zusätzliche Menü ein.
Probieren Sie der Reihe nach die Buttons aus und machen Sie sich mit ihrer Funktion vertraut.
Hinweise:
Einzelne rote Kugeln in der Abbildung stehen für Wassermoleküle. Bei Röntgenstrukturen kennt man die Positionen der H-Atome der Wassermoleküle nicht und lässt sie daher einfach weg.
Antialiasing schaltet eine bessere Abbildungsqualität ein und wieder aus. Die Seite wird durch Antialiasing aber langsam. Schalten Sie Option nur ein, bevor sie einen Screenshot erzeugen.
Infos einblenden [Position und Kürzel] (zweitunterste Zeile) funktioniert nur, wenn ein paar Aminosäuren zu sehen sind.
Halten Sie nun in der Skizze fest, welche zwischenmolekularen Wechselwirkungen auftreten. Klicken Sie dazu zuerst auf [hydrophile]. Sie sehen dann diejenigen Aminosäuren, die mit dem Inhibitor direkt oder indirekt Wasserstoffbrücken eingehen. Klicken Sie nun auf [hydrophobe] und untersuchen Sie, wo Enzym und Inhibitor über hydrophobe Bereiche miteinander in Kontakt treten. (Manche Aminosäuren sind bei beiden Auswahlen dabei).
Halten Sie nun in der Skizze fest, welche Bereiche des Sulfanilamids im Enzym verborgen sind und welche Kontakt mit der Lösung haben. Betätigen Sie zu diesem Zweck unter [weitere Tools] in der Mitte den Button [Spacefill]. Alternativ kann man auch in der untersten Zeile (Proteinhülle) den Button [opak] oder [transparent] verwenden - das dauert aber lange und die Seite wird dadurch langsam.
Wiederholen Sie die Schritte nun noch mit dem anderen Enzym.
Noch eine letzte wichtige Aufgabe ist jetzt zu lösen: Wenn Sulfanilamid an die Carboanhydrase (CA) bindet, verändert es sich. Es verschwindet ein Atom! Finden Sie heraus, welches Atom verschwindet, halten Sie die Veränderung in ihrer Skizze fest und erklären Sie!
Wie könnte man das Molekül nun verändern, so dass das neue Molekül zwar noch an das eine Enzym bindet, aber nicht mehr an das andere? Darum geht es bei der nächsten Aufgabe.
Sobald Sie beide Bindungssituationen untersucht und in einer Skizze festgehalten haben, ist diese Aufgabe gelöst. Sie sind nun bereit, spezifische Inhibitoren für das eine oder andere Enzym zu finden.
2.3.2. Nächste Aufgabe¶
2.3.3. Links¶
Diese Seite als  Word- oder
Word- oder  pdf-Dokument herunterladen.
pdf-Dokument herunterladen.