Propan-1-ol¶
IR-Spektrum und Schwingungen von Propan-1-ol. Die Farben der Buttons entsprechen den Farben im Spektrum: Die Schwingungen, die erscheinen, wenn die Buttons gedrückt werden, haben die entsprechenden Frequenzen im Spektrum.
Die obere Abbildung zeigt das Spektrum von gasförmigem Propan-1-ol, das untere dasjenige von gelöstem. Die Spektren weisen vor allem einen markanten Unterschied auf: Oberhalb von 3000 cm-1 tritt bei gasförmigem Propan-1-ol nur eine schmale Bande auf, die sich bei gelöstem zu einer sehr breiten Bande auswächst. Die 3D-Animation zeigt, dass diese breite Bande tatsächlich der Schwingung einer einzigen Bindung entspricht: Der OH-Streckschwingung der Hydroxyl-Gruppe. Wie kann diese Bande im einen Fall so schlank sein, im anderen so breit? Es hat damit zu tun, dass die Moleküle in der Gasphase einzeln auftreten, während die Moleküle in der Flüssigkeit miteinander Wasserstoffbrücken ausbilden. Diese Wasserstoffbrücken führen zu einer Verlangsamung der Schwingung und, weil verschiedene Bindungssituationen möglich sind, zu einer massiven Verbreiterung der Bande.
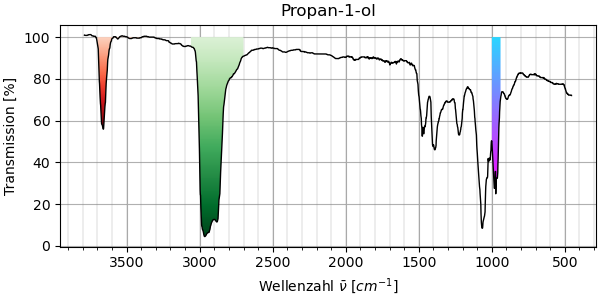
Abb 11. IR-Spektrum von gasförmigem Propan-1-ol¶
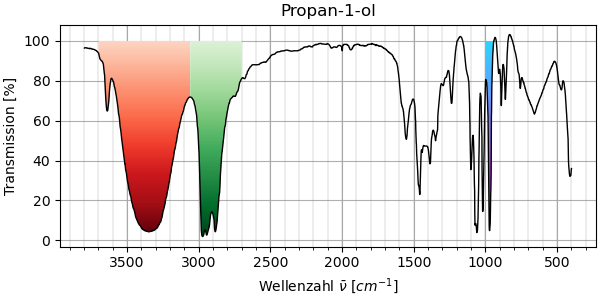
Abb 12. IR-Spektrum von gelöstem Propan-1-ol¶
